Тема 10. Ковалентная полярная химическая связь.
Часть I
1. Электроотрицательность (ЭО) - это способность атомов оттягивать к себе электронные пары.
3. Если ковалентная химическая связь образуется между атомами разных элементов-неметаллов, то общие электронные пары смещены в сторону более электроотрицательного элемента. На нём возникает избыточный отрицательный заряд, а на атоме-партнёре - избыточный положительный заряд. Такая связь называется ковалентной полярной.

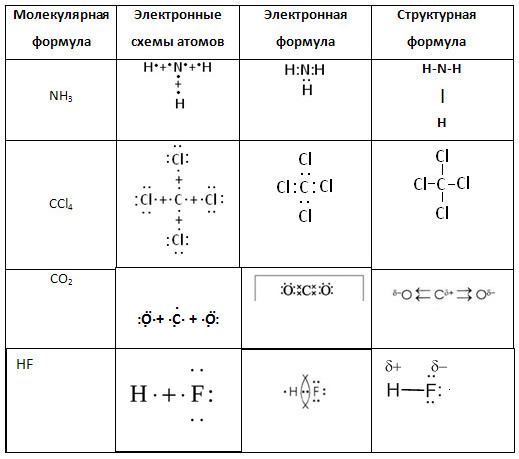
5. Дополните таблицу «Ковалентная полярная связь».
Часть II
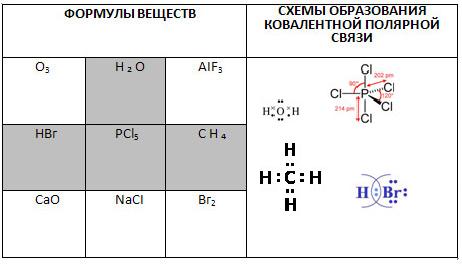
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.
2. Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла:
страз.
1) HF С
3) FeBr3 Т
5) SO2 Р
7) CO2 А
9) PCl5 З
3. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета. Сделайте вывод:
С увеличением порядкового номера ЭО растёт.
4. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицатель¬ности найдите с помощью Интернета.
В группе с увеличением порядкового номера ЭО уменьшается.
5. Наиболее полярной является химическая связь в молекуле:
4) фтороводорода - HF
6. Расположите следующие вещества в порядке уменьшения полярности химической связи.
4) фосфид калия - К3Р
2) фосфид алюминия - АlР
3) хлорид фосфора (V) - РСl5
1) белый фосфор - Р4